当前位置:首页 >
芯随糖动:激活葡萄糖激酶这一调糖芯片,有望让T2DM患者重塑血糖稳态自主调节
2型糖尿病(T2DM)的真相究竟是什么?近100年来,人类对于糖尿病的科学探索过程,在时代、认知和科技等因素的推动下,新的认知和治疗靶点像拼图碎片一样被一一发现,糖尿病的神秘面纱也被一步步揭开……
时至今日,关于T2DM机制认知的“拼图”逐渐丰满,糖尿病治疗也不断取得阶段性成果。目前认为,理想的血糖控制在于多维度下的综合管理。然而,涉及的机制越复杂,血糖管理维度越多,就越需要我们跳出局部、从整个系统的高度来重新审视糖尿病。别忘了,机体本身具备自主调控血糖稳态的能力!那么,有没有可能通过调动人体的自主调节能力来恢复血糖稳态呢?空军军医大学西京医院姬秋和教授对此进行了详细论述。

一、血糖稳态是什么?从系统角度重新理解2型糖尿病
正常生理状态时,人体血糖水平稳定在3.9~5.6 mmol/L,这种状态称之为血糖稳态。血糖稳态是确保大脑等重要脏器、红细胞等依赖葡萄糖供能的细胞发挥正常生理功能的基础。
而T2DM各种复杂机制所导致的共同特征就是血糖失稳态,临床表现为持续高血糖、餐后血糖显著升高、血糖波动大、低血糖频发等。从某种程度来说,2型糖尿病就是血糖逐渐失稳态的过程。
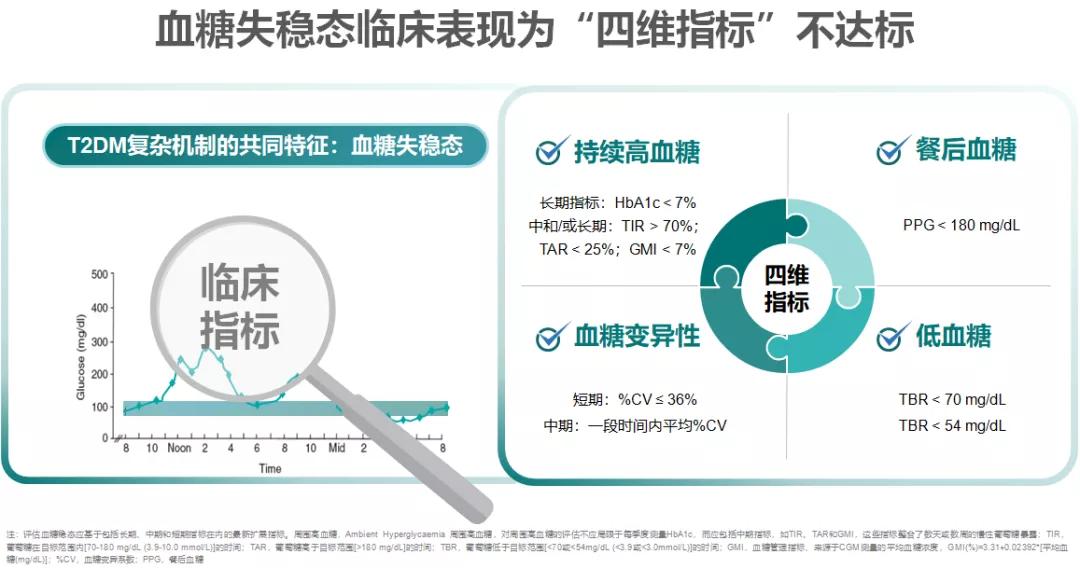
二、血糖稳态是如何维持的?葡萄糖激酶(GK)被视为血糖调控系统的“芯片”
01血糖稳态由系统中多个靶器官、高度智能化的协作共同维持
正常人体内存在一整套精细调节糖代谢的机制,当一次性摄入大量葡萄糖后,血糖水平不会持续升高,也不会出现大的波动。这得益于多个参与葡萄糖调控与利用的器官共同组成的血糖稳态系统,共同维持血糖稳态,主要包括大脑、胰岛、肝脏、肠道、肌肉与脂肪等。
当血糖水平发生变化时,血糖稳态系统感知到葡萄糖水平的变化,系统中靶器官各司其职进行血糖调节与平衡,维持正常血糖稳态。在这个过程中,葡萄糖集调节变量与受控变量于一身。简言之,葡萄糖水平变化一方面左右着稳态系统的调节作用,同时葡萄糖本身就是稳态系统所调控的目标所在。
而肝脏/胰腺/肠道作为核心调糖靶器官,何时发挥调糖作用,则取决于葡萄糖调定点的高低。所谓葡萄糖调定点,即激发调糖靶器官开始发挥作用的葡萄糖浓度值,胰腺(α/β细胞)、肠道、肝脏各自具有对应的葡萄糖调定点,其调糖作用在各自对应的葡萄糖阈值下开启。例如,对于胰岛β细胞,葡萄糖调定点约为5 mmol/L,当血糖浓度>5 mmol/L时,即可激发β细胞分泌胰岛素。
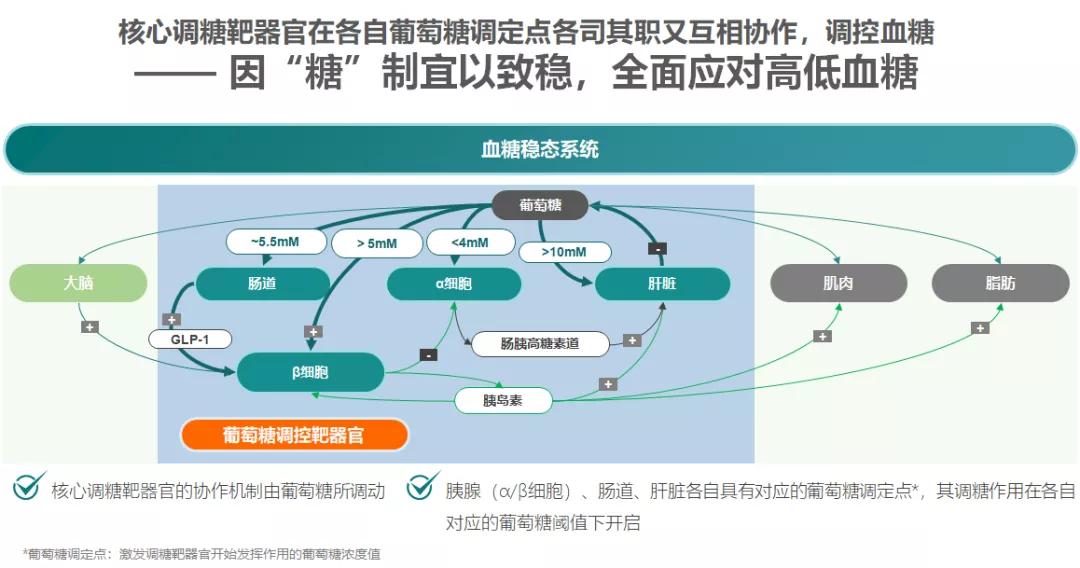
那么,葡萄糖调定点又是由谁来感知的呢?这就涉及一个重要结构——作为葡萄糖传感器的葡萄糖激酶(GK),正是GK的作用确保了调糖靶器官在各自葡萄糖调定点能各司其职又互相协作。
02葡萄糖激酶(GK)如同“芯片”,启动核心调糖靶器官之间精密协作
在复杂而精密的血糖稳态系统中,GK如同“芯片”般同时存在于各核心调糖靶器官中,启动着各器官之间的精密协作,协调稳态系统运作。
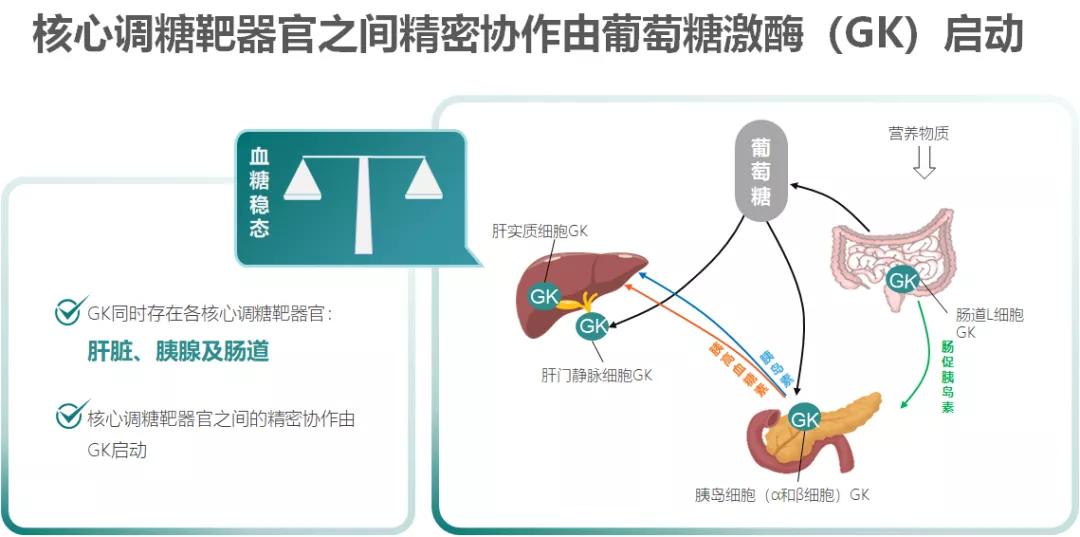
GK是一种单体变构酶,随葡萄糖浓度水平发生构象变化,从而感知葡萄糖水平。GK同时也是核心调糖靶器官细胞内代谢的第一个关键酶,将葡萄糖催化为葡萄糖-6-磷酸,从而启动后续的调糖机制。也就是说,GK是葡萄糖调控的第一步。正如“春江水暖鸭先知”,葡萄糖高低则是GK先知。
下面我们就来具体看看,核心调糖靶器官是如何通过GK敏锐地感受葡萄糖浓度的变化,从而及时开启降糖或升糖机制以维持血糖稳态的?
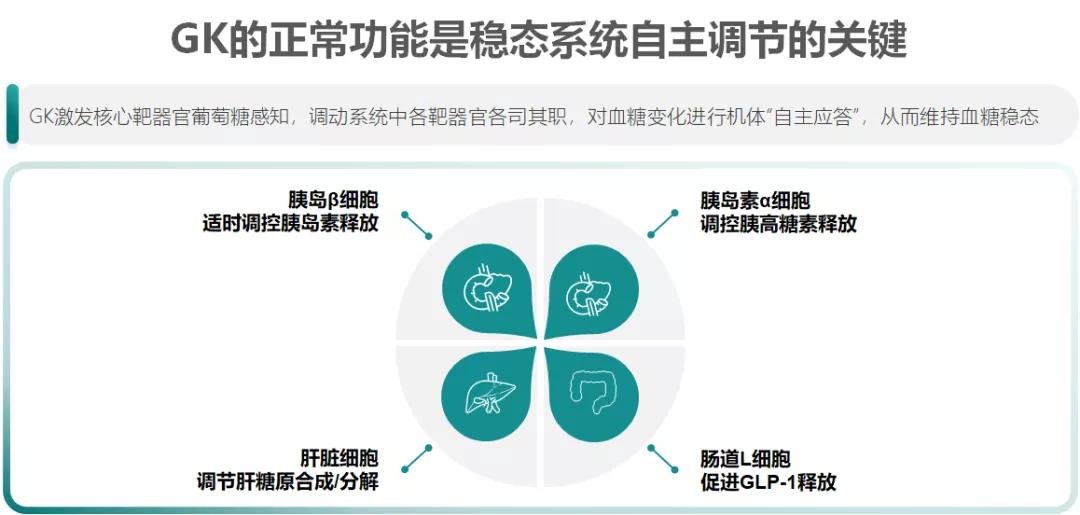
胰腺:葡萄糖浓度>5 mmol/L时,胰腺β细胞GK被激活,启动胰岛素分泌。
肝脏:一方面,早相胰岛素作用于肝脏细胞,促进肝细胞GK基因表达,储备足够量的GK;另一方面,当葡萄糖浓度>10 mmol/L时,肝细胞GK与葡萄糖调控蛋白解离,GK在肝细胞质中恢复酶的活性,启动肝糖原合成,抑制肝糖原分解。
肠道:葡萄糖浓度≈5.5 mmol/L时,肠道L细胞GK激活,启动分泌胰高糖素样肽-1(GLP-1),促进胰岛素分泌。
而当葡萄糖浓度降低至4 mmol/L以下时,胰岛α细胞GK活性迅速下降,启动胰高糖素释放,后者作用于肝细胞受体,启动肝糖原分解和糖异生机制,为机体输送葡萄糖,维持血糖稳态。
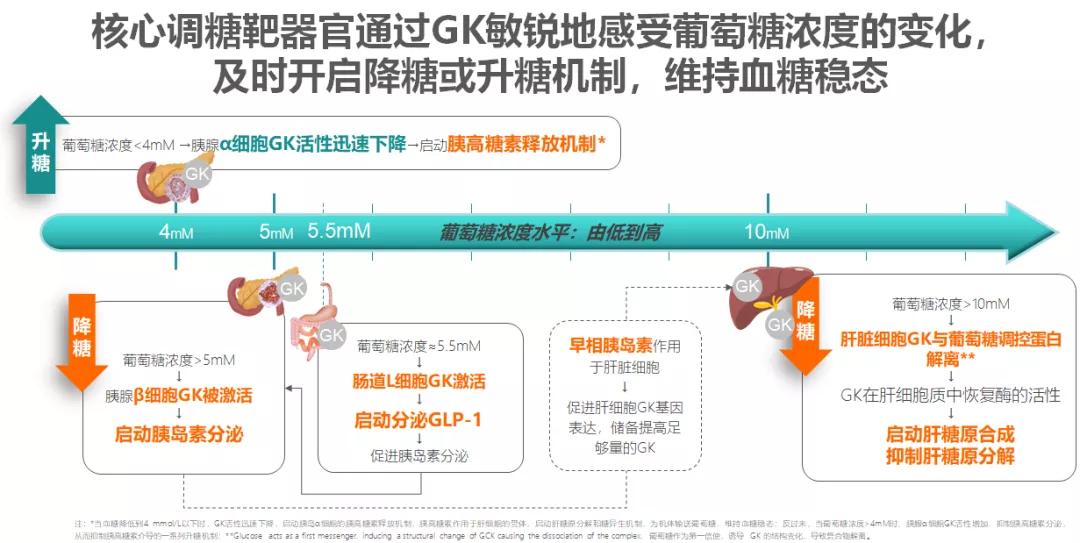
可以说,GK的正常功能是血糖稳态系统自主调节的关键。GK这个“芯片”通过激发核心靶器官葡萄糖感知,调动各器官对血糖变化进行机体“自主应答”,从而维持血糖稳态。
三、T2DM患者血糖失稳态:葡萄糖激酶(GK)损伤/功能降低是“硬伤”
既然GK作用如此重要,一旦这个“芯片”失灵(GK功能受损),则不能准确感知机体内葡萄糖浓度变化,从而导致各个调糖靶器官对血糖变化“视而不见”,不能正常启动控糖激素的分泌,最终破坏血糖稳态系统。这一点已得到一系列基础及人体研究的证实。
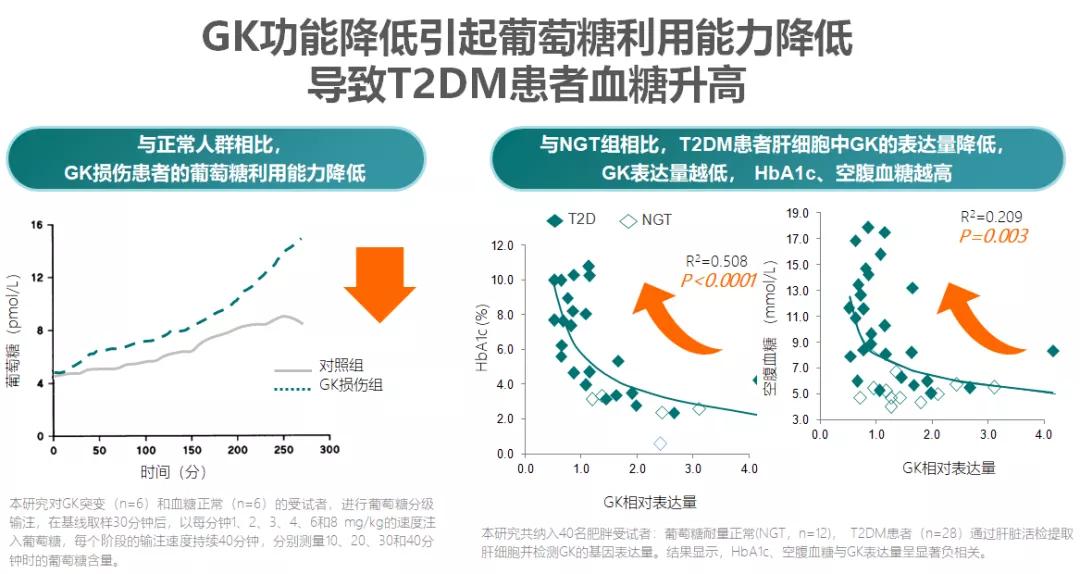
研究显示,T2DM患者普遍存在GK损伤,GK功能显著降低。在T2DM患者胰岛β细胞与肝细胞中,GK基因表达量均比正常人群下降约40%,肝脏GK活性下降约50% 。动物实验和人体研究显示,GK功能降低会导致控糖激素(胰岛素、胰高糖素等)分泌失常、肝糖原合成受阻、葡萄糖利用能力降低。与血糖正常人群相比,T2DM患者不仅肝细胞GK表达量下降,而且GK表达量越低,患者HbA1c、空腹血糖水平就越高。
四、“重塑自主”的全新理念:“中国原研芯片激活器”助力血糖稳态自主调节
综上,稳态系统自主调节失常导致血糖失稳态是T2DM发病的共同基础,而GK“芯片”功能受损是血糖失稳态的关键机制。认识GK在糖尿病发生发展中的作用非常重要,有助于我们对糖尿病的认知从胰岛素、肝脏、胰腺、肠道等单一视角进一步拓展到系统协调的、整体的高度。
GK自被发现以来已有半个世纪,目前已有多种GK激活剂(GKA)进入临床研究阶段,其机制就是通过激活GK这个葡萄糖传感器,协同胰腺、肝脏和肠道等血糖调控核心器官,有助于重塑血糖稳态。其中,多格列艾汀(dorzagliatin)是全球率先进入临床Ⅲ期研究的GKA,也是由我国自主研发的糖尿病首创新药,其上市申请已于2021年4月获国家药品监督管理局(NMPA)受理。
糖尿病治疗理念不断推陈出新,“重塑自主”的全新理念可能让我们更加接近糖尿病的真相。毕竟,授人以渔的治疗对策更贴近生理状态,让机体尽量恢复对血糖稳态的自主调控或将成为糖尿病治疗的新目标。多格列艾汀作为“中国原研芯片激活器”,将如何在临床实践中助力T2DM患者重塑血糖稳态自主调节,让我们共同期待!
参考文献
1. 李小英. 中华糖尿病杂志. 2019; 11(7): 500-502.
2. Matschinsky FM, Wilson DF. Front Physiol. 2019; 10: 148.
3. 陈力. 药学进展. 2016; 40(3): 161-167.
4. Röder PV, et al. Exp Mol Med. 2016; 48(3): e219.
5. Toulis KA, et al. Drugs. 2020; 80(5): 467-475.
6. Matschinsky FM. Nat Rev Drug Discov. 2009; 8(5): 399-416.
7. Li C, et al. J Biol Chem. 2013; 288(6): 3938-3951.
8. Haeusler RA, et al. Mol Metab. 2014; 4(3): 222-226.
9. Caro JF, et al. Horm Metab Res. 1995; 27(1): 19-22.
10. Byrne MM, et al. J Clin Invest. 1994; 93(3): 1120-1130.
11. Basco D, et al. Nat Commun. 2018; 9(1): 546.
12. Hayashi H, et al. Biochem Biophys Res Commun. 2015; 460(3): 727-732.
