当前位置:首页 >
低 温 生 物 医 学 的 前 世 与 今 生
低温生物医学是研究低温与生物体相互作用规律及其医学应用的学科。目前,低温生物医学应用主要涉及低温保存及低温治疗两方面(图1)。其中,
低温保存是指将生物材料(如细胞、组织、器官)在添加低温保护剂的情况下冷却至低温(一般为-196 ℃液氮保存),待需要时再将其以有效的方式复温至正常温度(37 ℃),此时生物样品仍可恢复并保持其活性。
低温治疗则是以微创介入的方式将探针插入肿瘤组织,手术开始后启动低温探针,通过探针内部冷介质在探针头部与肿瘤组织的冷量交换,使肿瘤组织处于低温环境,冰球完全覆盖肿瘤靶病灶组织(≤-20 ℃)并维持一段低温治疗时间,以达到杀死肿瘤细胞的目的,手术结束后取出探针,肿瘤原位消解。
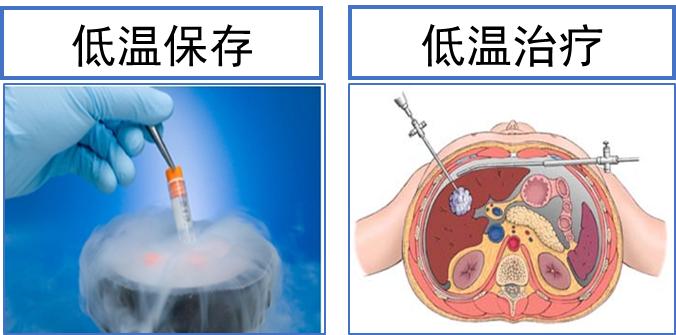
图1 低温保存及低温治疗示意图
1. 凝固时光的技术——低温保存
在低温下,生物体新陈代谢的速率大大降低(图2),进入“生理机制暂停”的状态,同时有效躲避了外界干扰,为“无限期”保存创造了条件,因此低温保存能使生物材料得以长期安全保存。一般来说,样品保存的温度越低,保存的时间就越长,在4 ℃时存活时间只有数小时的生物样本,在-80 ℃下可以保存数月,在-196 ℃下,随着反应速率近乎于0,能保存数世纪。目前,低温保存技术是生物材料长期保存的唯一可行途径。
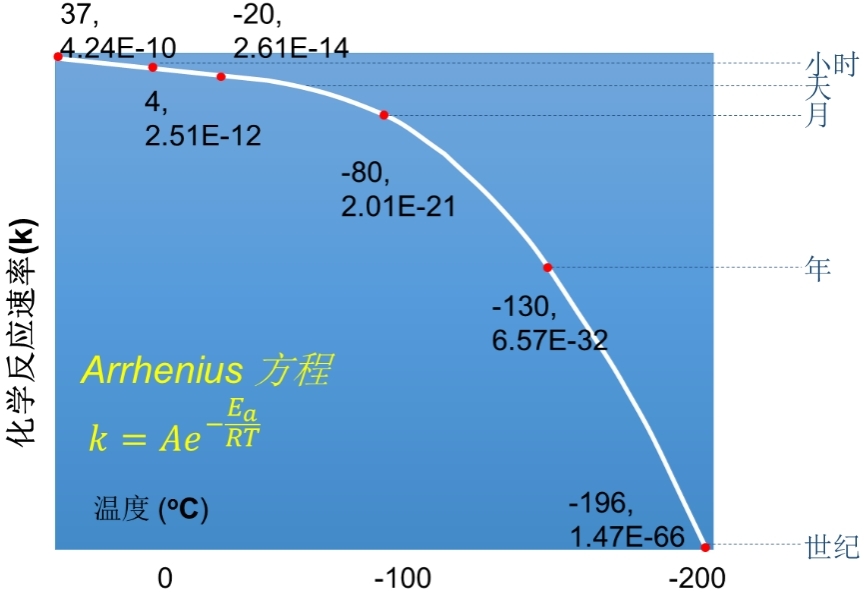
图2 生物样品低温保存的时间与温度之间的关系
在植物种子质量(即种质)的长期保存上,低温保存提供了必不可少的技术支撑,具有省事、省工、省费用的特点,尤其适合长期保存珍贵稀有种质。一位俄罗斯科学家利用三万年前冰冻在西伯利亚科雷马河永冻层里的种子,成功培育出一棵植物,打破复苏最古老植物种子的记录(图3),事实上正是低温环境使得该物种的遗传物质得以完整的保存,帮助这枚种子安全度过三万年的休眠期。在挪威斯瓦尔巴特群岛上,有一个全球最大的植物末日种子库(图4),以防因全球物种迅速缩减而造成物种灭绝,被称为“世界末日”地球资源的诺亚方舟。

图3 俄罗斯科学家复苏三万年前的种子

图4 挪威植物末日种子库
在新兴的医学前沿领域,利用现代低温保存技术,人类精子、卵子及胚胎长期保存已成为现实(图5)。1983年,世界首例“冷冻宝宝”出生,人类胚胎冷冻保存技术逐渐发展成熟,低温冷冻保存技术逐渐成为辅助生殖技术中不可或缺的重要技术之一。2017年年末,美国冷冻了24年的胚胎宝宝出生,打破了保存最久冷冻胚胎成功生产的世界纪录。现代胚胎保存是将胚胎和低温保护液装入专用的冷冻管中,通过慢速(对于第2-3天的胚胎)或者快速(玻璃化保存,对于第5-6天的囊胚)的方法使胚胎浸入-196℃的液氮中,减少代谢从而得以保存。目前,稳定的高复活率的胚胎冷冻技术仍然是研究人员追求的目标,这将为不孕不育患者保存生育能力、延续生命提供了基础技术支持。
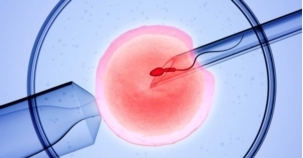
图5 低温保存辅助生殖技术
除此之外,各类生物样本库(如生殖样本库、疾病样本库、中华民族生物样本库及干细胞库)的建设,为保存各种人类资源都起到了重大作用。特别是,对于器官移植,临床上目前多采用短期低温保存或延时保存技术(4℃左右),但器官的冷缺血耐受时间(不损害器官结构功能的前提下,从放置在低温环境到正常恢复血供的时间)较短,心肺为4小时,肝、肠、胰腺为8~12小时,肾最长为36小时,但其功能细胞-肾小球耐受时间只有不到24小时。这导致了目前临床上超过70%的心脏因为评估和匹配的所需时间超过了保存限制而被废弃。以我国肾器官移植现状为例,每年需要进行移植的人约有30万,但实际只有2000多人能及时获得适配器官接受手术。因此面对器官库短缺以及可用率低的问题,最有效的解决方案就是寻求器官长期有效的低温保存方法,目前这一方向仍是全球挑战性的重大难题。
在抗击新冠病毒的医疗领域,低温保存技术也发挥了重要的作用。由于不同疫苗有着不同的储运条件,这给冷链储存带来巨大挑战,其中抗击新冠疫情的mRNA 疫苗,对低温储运的要求极为严格(图6),需要动态的深低温储运环境。针对不同的疫苗储运,目前已制定了标准的保存流程,为新冠疫苗的冷链输运提供坚实的技术支持。

图6新冠病毒疫苗低温保存参数
低温保存技术历经数十年的发展,在实验方法上取得了巨大成功,特别是近几十年来,利用低温保存技术,已成功地实现了对绝大多数种类细胞的保存,在皮肤、角膜等简单组织的低温保存上也取得了一定进展,并在组织再生及器官移植中得到广泛应用,极大地推动了临床医学的发展。器官甚至是活体的保存挑战仍在推动着这一领域的向前发展。
2. 肿瘤绿色治疗方法——低温治疗
早在古埃及时代,人们就通过冷敷来减轻炎症,低温的治疗作用已被意识到。近世纪以来,战场上,医护人员利用低温减轻肢体手术的疼痛。而近年来,低温对于减缓癌症发展、治疗肿瘤的作用也逐渐被人们认识。
低温治疗肿瘤(图7),通常是以一种微创的方式将冷冻探针直接插入到肿瘤部位,并利用制冷技术在探针针头实现可控的降温和升温功能。在冷冻过程中,探针周围会形成冰球,使肿瘤组织温度低至-20 ℃以下,并维持一段时间,通过探针持续不断地冷冻、解冻病灶,产生一系列不可逆损伤,达到消除病灶的目的。与其他治疗方式相比,低温手术由于具有影像可视、麻醉镇痛、止血或减少出血、手术创口小以及能防止肿瘤扩散等优点,并且其副作用远低于放疗和化疗,因而在肿瘤治疗方面赢得了“绿色疗法”之誉。低温外科手术已拓展应用到几乎所有的实体肿瘤治疗,被学术界和医学界公认为是一种治疗肿瘤的重要方法。
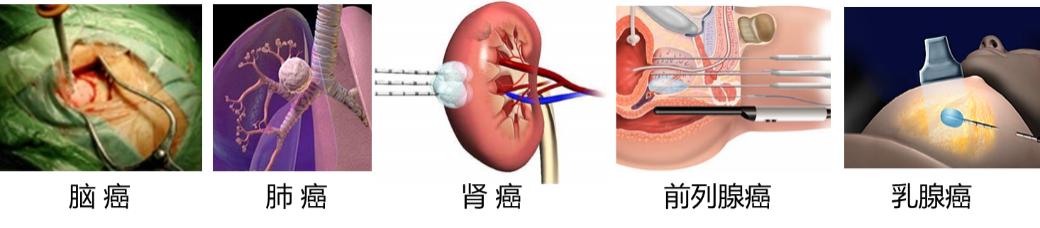
图7 低温治疗肿瘤
低温治疗癌症效果明显,复发率低。早在1961年,美国医生I. S. Cooper就首次运用液氮冷刀,取得了良好的医疗效果。2002年,日本庆应大学医学院利用低温治疗42例晚期肝癌患者,肿瘤的完全消融率达到了92.2%。2017年,美国研究人员在学术期刊JVIR上发表了一组关于低温治疗肾癌的临床数据,共302名肾癌患者接受了低温治疗手术,32个月后,肿瘤的复发率仅为3.2%。
低温治疗癌症蓬勃发展,对于癌症患者来说,不仅仅是治疗上有了新的更加低痛苦的选择,更是带来了生的希望。临床上,对各种类型的早中晚期恶性实体瘤(比如肝癌、肺癌、乳腺癌等)患者,均可采取低温治疗方式。特别是对于那些失去了常规手术治疗机会的晚期患者、转移患者、年龄大或身体虚弱患者、不愿意进行常规手术的患者,低温治疗癌症为他们提供了生的希望。
随着低温外科手术(也被称为冷冻治疗)在恶性肿瘤治疗中令人鼓舞的大量成功应用,肿瘤微创冷冻治疗逐渐成为微创医学特别是低温生物医学技术在现代临床实践中发挥重大关键性作用的一个典范(图8)。以中国为例,经过短短十余年的快速发展,目前全国已有超过100家医院(如中国人民解放军总医院、中国医学科学院肿瘤医院、北京肿瘤医院、复旦肿瘤医院等)开展肿瘤冷冻治疗业务,并呈快速增长趋势;而在美国,开展冷冻治疗的医院已超过450家(如MD Anderson Cancer Center, Mayo Clinic, Mountain Sinai Hospital等)。最近几年,全球多个区域还纷纷成立冷冻治疗学会,旨在推进这一新型高效肿瘤疗法的研究和应用。不难看出,国内外医学界对肿瘤冷冻治疗技术具有广泛而迫切的重大需求。
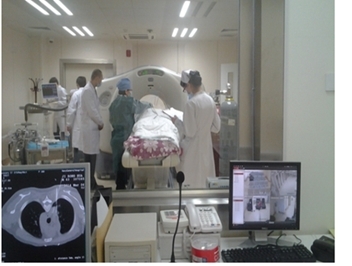
图8一体式低温冷冻肿瘤微创治疗系统用于临床治疗肿瘤
3. 低温双刃剑:默默无闻的保护 or 所向披靡的破坏?
低温保存与低温治疗都是通过低温来实现,那么两者之间有什么差异呢?究竟两者如何区分呢,又如何确保各自的效果呢?

低温保存与低温治疗具有类似的操作流程:实施降温使生物样本处于低温环境,再通过复温使生物样本处于常温环境中。
但是低温保存与低温治疗也有本质的不同:
添加物不同:对于绝大部分哺乳动物有核细胞的低温保存来说,无论是慢速冷冻保存还是玻璃化冻存都需要添加一定浓度的冷冻保护剂来避免低温损伤;而低温治疗则不需要添加保护剂,甚至有时会添加强化破坏作用和细胞损伤的冷冻增敏剂。在同样的升降温条件下,是否添加低温保护剂决定了大多数生物样品在低温下产生的是保护作用还是破坏作用。
降温/升温参数不同:不同的降温及升温速率导致的细胞破坏力不同(见图9)。在低温保存过程中,对于大部分哺乳类细胞,经常采用的是慢速低温保存方法,慢速冷冻保存的降温速率需要进行优化,合适的降温速率有助于维持冰晶损伤与溶液损伤之间的平衡(如图9所示),对于一般的哺乳类细胞,降温速率经常采用1 ℃/min;而在升温过程中,需要比较快的升温速率,且复温温度不应达到细胞热损伤温度,样品从-196 ℃液氮中取出放到37 ℃水浴中快速复温,这个过程一般控制在1~2 min。在低温治疗过程中,探针附近的组织降温速率较快,一般是47~116 ℃/min;距离探针中心约1 cm处,冷却速率降为10~20 ℃/min;所以通过对探针插入位置的调整,可以在对肿瘤进行适形化冷冻杀伤的同时,避免对周围非肿瘤组织的冷冻损伤。升温速率也非常快,从-196 ℃到80 ℃加热循环开始,一般是控制在2 min之内,迅速在深低温及高温之间切换组织产生的热应力所造成的机械损伤对肿瘤细胞产生了致命的破坏。值得指出的是,当降温速率足够快时(比如,纯水的临界降温速率为3×108 ℃/min),可以实现低温玻璃化保存(如图9a),但冷冻治疗设备一般都达不到这个速度,所以低温治疗设备只能起到低温破坏作用。
除了升降温速率不同,低温保存和低温治疗的冻融循环次数也不同。低温保存是为了让生物样本在低温下维持低代谢甚至是零代谢状态,从而保持生命周期,所以生物样本在低温保存中只会经历一次冻融循环。而低温治疗,会根据要求对肿瘤组织进行一次或多次冻融,以加强对肿瘤组织的破坏性。Whittaker对仓鼠口腔粘膜进行了反复冻融,发现细胞内冰晶会在每次冻融循环的间隔中增加。所有,目前为了破坏肿瘤组织,需要快速冷冻组织,并进行反复冻融。
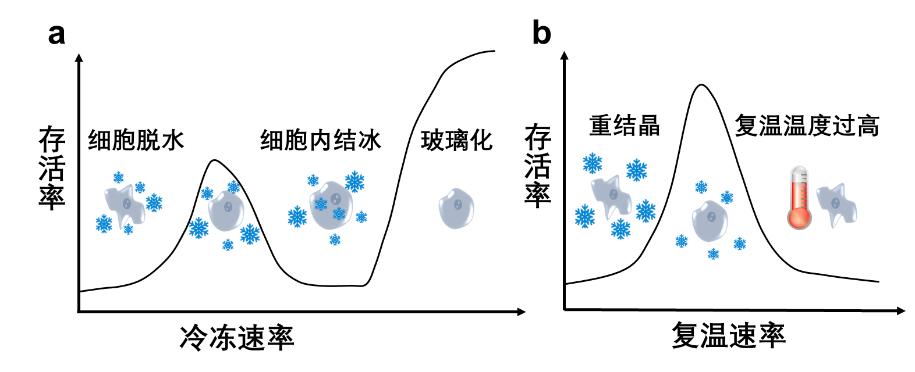
图9 不同降温及升温速率下的细胞损伤曲线。
低温作用对象尺度不同:低温保存目前可以实现血细胞、悬浮细胞液、卵母细胞等细胞尺度样品的成功冻存,对于 1 mm以下的单一功能生物样本如皮肤、角膜等也可以实现较高的存活率,但是,目前最为先进的低温保存技术对于1 mm以上的复杂生物样本(包括血管与多种异质细胞)仍存在严峻挑战。而对于低温治疗的肿瘤组织,直径一般都在5 mm以上。随着生物样本体积增大,传热速度不均匀性增大,以及冰晶形成释放大量潜热,大尺度生物样本的均温一直是个难题。温度的不均匀性及组织各向异性等引起热收缩不均匀,会造成严重的热应力。当热机械应力超过生物组织极限时,会造成生物样本的永久性损伤,这对于生物样本在低温下的存活是极其不利的。
控冰作用不同:在低温保存过程中,需要借助材料和技术的手段,减少相变过程中冰核的形成、抑制冰晶的生长和重结晶的出现;而在低温治疗过程中,反而需要强化破坏作用,冰核的形成、冰晶的快速生长及重结晶则有助于破坏肿瘤(图10)。
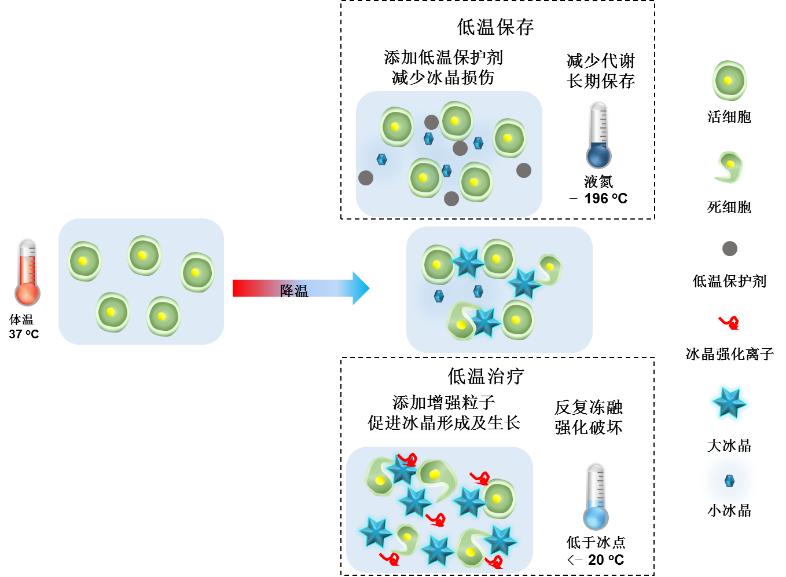
图10 低温保存与低温治疗差异性
由于生物样本中大部分成分为水(超过70%),所以控制冰晶的形成及生长对于低温保存功至关重要,通过选择合适的低温保存保护剂及低温治疗增敏剂可以实现冰晶的生长调控,那么,一般情况下应该如何选择呢?
通过添加抑冰材料(低温保护剂)来调节冰晶成核和控制冰生长和形状是十分可行的途径(图11)。1949 年,英国生物学家 C. Polge 和 A. U. Smith 偶然发现甘油可以帮助精子经历低温冷冻而不死亡,使低温保护剂作为低温保存的一个重要研究方向登上历史舞台。低温保护剂可以帮助保护生物样本免受低温损伤,在细胞冻存中常被配制成一定浓度的溶液,其可以通过减少冰形成量来减少细胞脱水。低温保护剂在降低冰晶形成速率方面表现突出。低温保护剂如多元醇和糖,特别是海藻糖和蔗糖,甚至可以替代与其结构相关的水,并防止变性或相变,以保护膜和蛋白质免于冷冻期间的干燥应激。在冷冻保存方案的设计中,选择合适的冷冻保护剂组合,优化低温保护剂的浓度对于生物样本低温保存效果的影响非常大。

图11 低温保存剂对于抑制冰晶形成、生长、及修饰冰晶形貌的作用
在体环境下水溶液成核及冰晶生长可通过添加功能颗粒来增强。相关研究结果表明,高热导率功能颗粒的加载所产生的冷冻效果提升十分显著(图12)。而且,注射不同的功能颗粒悬液会产生不同的冷冻增强效果,该特性用于低温手术中可对目标组织的冷冻效果实施调控。此外,靶向冰晶成核剂的引入还会在降温过程中强化肿瘤细胞特定位点的冰晶成核。
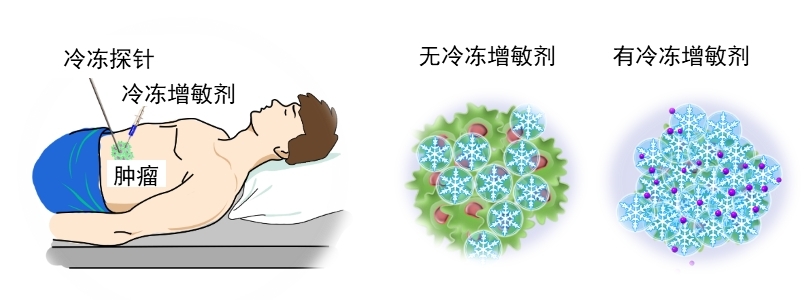
图12导热增强功能材料促进冷冻过程冰晶形成
对于冰晶生长的精准调控是减少细胞冷冻保存损伤或强化细胞冷冻杀伤的基础(图13)。简单来说,无论是低温保存和低温治疗都需要精准控制细胞内外结冰的时空分布。
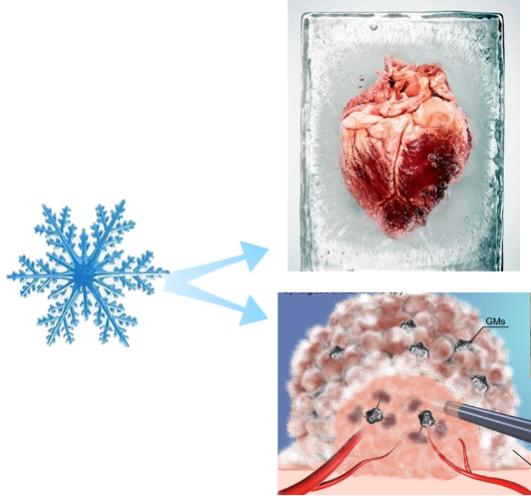
图13 冰晶生长的精准调控实现低温保存及低温治疗
4. 未来:低温保存——无冰共生,低温治疗——遇冰皆消
在低温保存领域,目前对于一些简单的细胞,已经能够实现比较理想的冻存复活率,但是对于复杂的多细胞生物体系,如大尺度组织、器官,甚至是复杂的生命活体的低温保存仍有待于破解,低温对于大尺度生物样本生命周期的拓展深深吸引着研究人员的注意。
在低温治疗领域,如何确保复杂生理环境下肿瘤的适形化消融以达到最优化治疗效果,仍远未达到理想的程度,甚至因诸多活体因素制约,情况更为复杂。精准化适形化的低温治疗技术是未来的主要发展方向。
低温生物医学工程学北京市重点实验室,中国科学院理化技术研究所
窦蒙家, 李晓莹,饶伟*
